Corps purs et Mélanges
Les Notions et Attendus
- Échelle macroscopique : espèce chimique, corps purs, mélanges, composition de l’air, masse volumique, propriétés des changements d’état, solutions : solubilité, miscibilité.
- Échelle microscopique : molécules, atomes et ions, constituants de l’atome (noyau et électrons) et du noyau (neutrons et protons), formule chimique d’une molécule, formules \(O_2\), \(H_2\), \(N_2\), \(H_2O\), \(CO_2\).
1. Espèce Chimique
Définitions
Une espèce chimique est un ensemble d'entités chimiques identiques.(Rappel : Une entité chimique peut être un atome, une molécule ou un ion).Exemples
- L'eau est l'espèce chimique constituée de La molécule \(H_2O\)
- Le sel aussi appelée chlorure de sodium \(NaCl\)
- Le sucre formée d'un ensemble de l'entité chimique saccharose \(C_{12} H_{22} O_{11}\)
- L'or constitué uniquement d'atome d'or \(Au\)
Comment identifier une espèce chimique
Contrairement à l'entité chimique seule, l'espèce chimique possède des propriétés physiques comme un état (liquide, solide, gaz), des températures associée aux changement d'état et une masse volumique. Ce sont des propriétés que nous pouvons mesurer afin d'identifier une espèce chimique.Capacité expérimentale
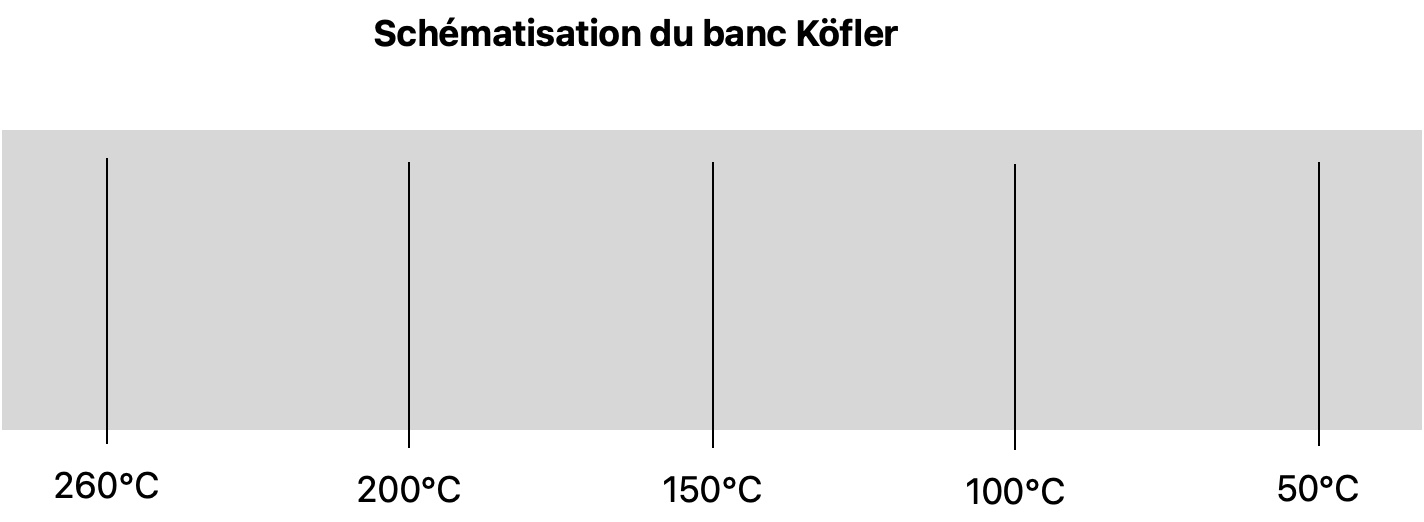
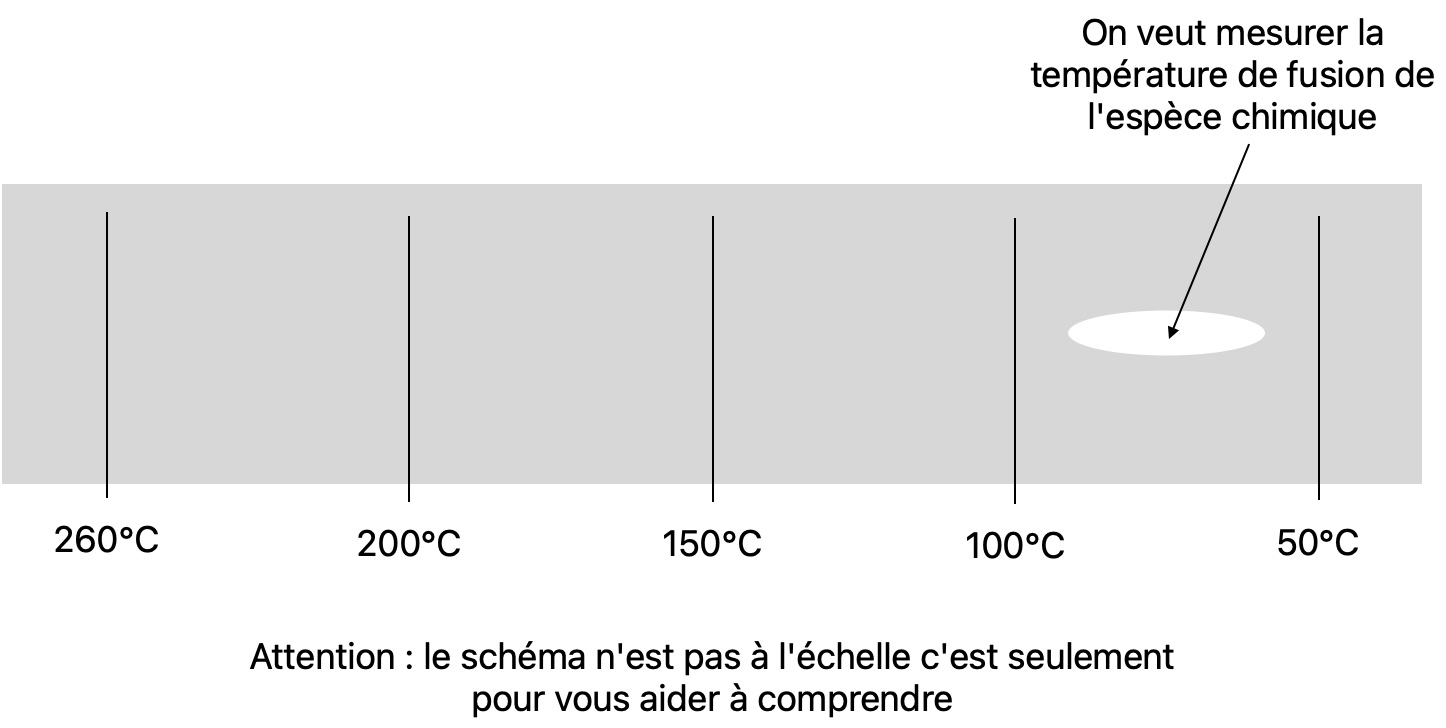
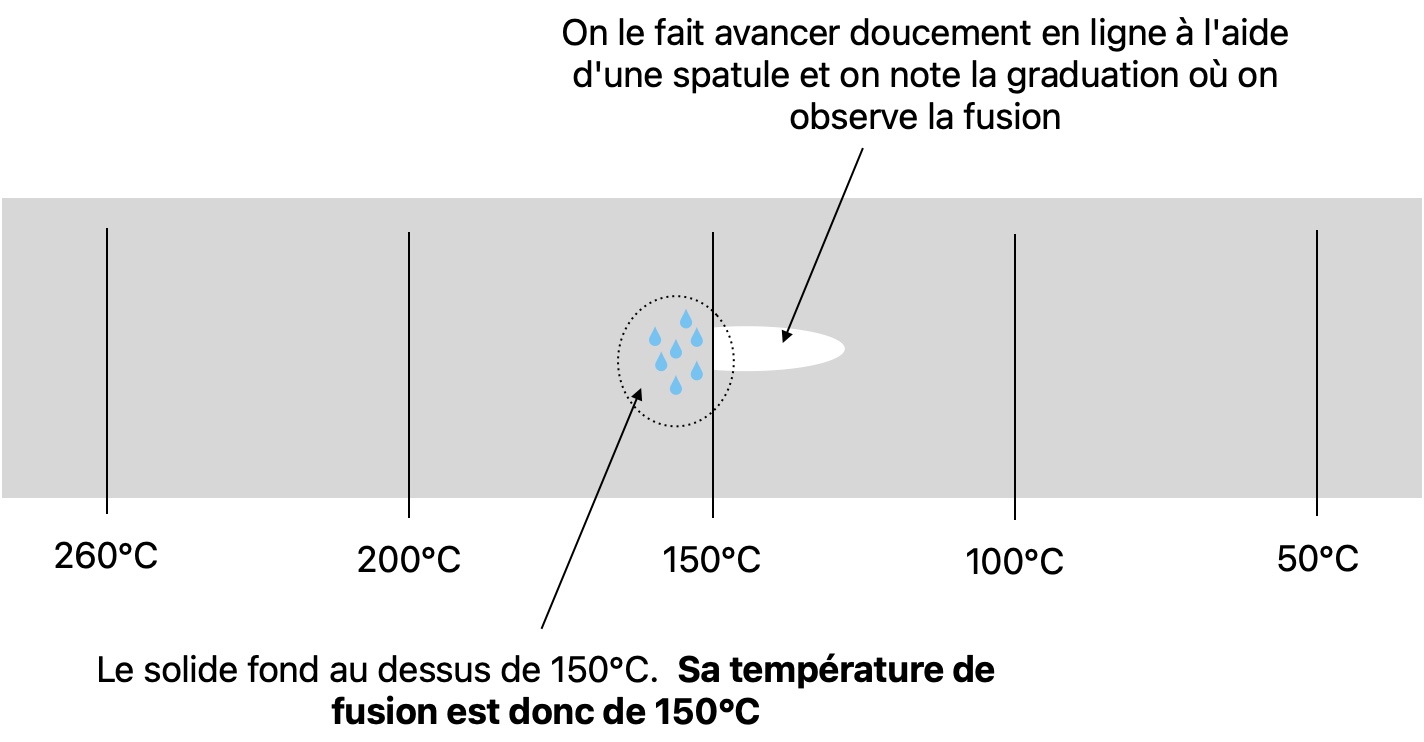
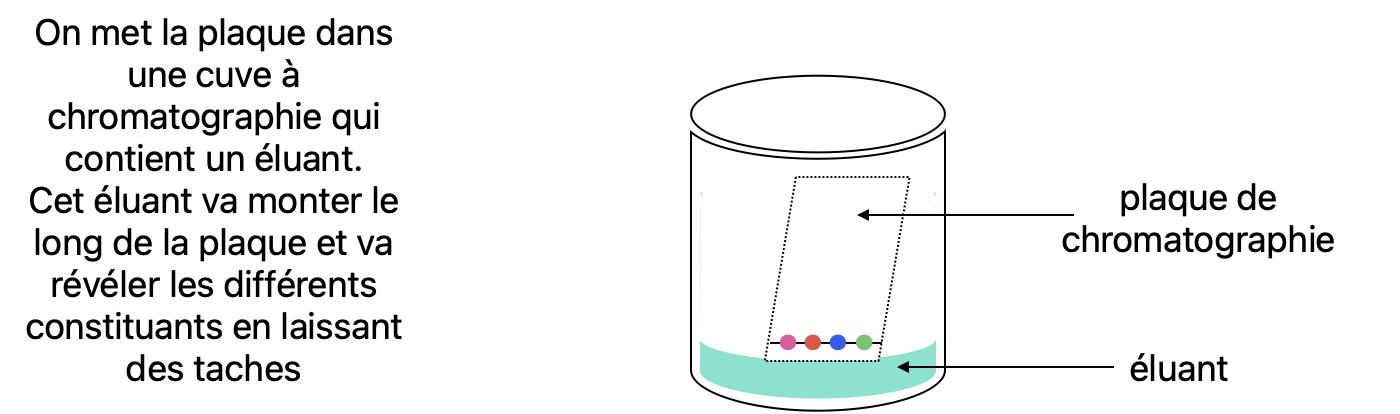
Vous trouverez le détail sur la CCM p304 du livre. Vous pouvez aussi regarder la vidéo suivante Le banc Köfler par Gérard Moreau. Je donne ici un aperçu.
En TP on disposera d'un échantillon d'une espèce chimique en poudre dont on veut connaître la température de fusion. Il faudra alors le disposer sur un banc Köfler. c'est une plaque de métal graduée en température, tout comme votre règle est graduée en centimètre, sauf que là au lieu d'aller de 0cm à 20cm le banc Köfler va généralement de 50°C à 260°C environ.
2. Corps Purs
Définitions
Un corps pur est constitué d'une seule espèce chimique.Exemples
- Le sel est un corps pur
- l'eau distillée est un corps pur dont l'espèce chimique est \(H_2O\)
- Le savon n'est pas composé d'une seul espèce chimique (voir liste des ingrédient derrière une bouteille de savon) ce n'est donc pas un corps pur
Contre-exemple
- La mayonnaise n'est pas un corps pur
- Une pâte à gâteau n'est pas un corps pur
Est-ce que corps-pur = espèce chimique ? oui
Une espèce chimique est un corps pur mais si on utilise le terme corps pur c'est pour pouvoir le distinguer de celui de mélange. Après avoir lu la définition d'un mélange on retiendra que tout ce qui nous entoure est composé d'espèces chimiques. Un mélange en contient plusieurs. Un corps pur en contient une seule.3. Mélanges
Définitions
Un mélange est composé de plusieurs espèces chimiques. Il est hétérogène si on peut distinguer à l'oeil nu ses différents constituants. Sinon, il est homogène.autrement dit :
Prenez quoique ce soit qui vous entoure, si ce n'est pas un corps pur c'est un mélange. Si on voit à l'oeil nu que c'est un mélange alors il est hétérogène sinon il est homogène.Exemples
- la mayonnaise : mélange homogène car on ne voit pas les différents ingrédient
- la bière : mélange hétérogène car on voit la mousse et les bulles de gaz
- L'air qui nous entoure : mélange homogène, il est donc constitué de plusieurs espèce chimiques dont 78% de diazote \(N_2\), 21% de dioxygène \(O_2\) et 1% d'autres gaz.
- La plupart des choses qui nous entoure sont des mélanges
Pourquoi ?
- Imaginez qu'une odeur agréable retienne votre attention dans la nature (une fleur ou un fruit par exemple) si vous étiez en capacité d'isoler l'espèce chimique qui en est responsable vous pourriez par la suite la synthétiser et l'introduire dans un flacon pour vous faire un parfum.
- Un autre cas ou l'on veut pouvoir distinguer entre corps pur et mélange est lorsqu'on synthétise un corps pur. Les dernières étapes d'une synthèse consiste a purifier le produit synthétisé. On voudrait ensuite être capable de vérifier qu'il ne reste pas d'impuretés. Car, par définitions, s'il y a des impuretés, nous n'avons pas synthétisé un corps pur. Si vous continuez la physique en spé vous serez amené à effectuer des synthèses d'aspirine ou de paracétamol (principe actif du doliprane), à la fin de ces synthèses il faudra vérifier que vous n'avez pas de résidus qui pourrait être nocif.
- On pourrait citer aussi la nécessité de détecter des polluants dans l'eau et l'air
Capacité expérimentale
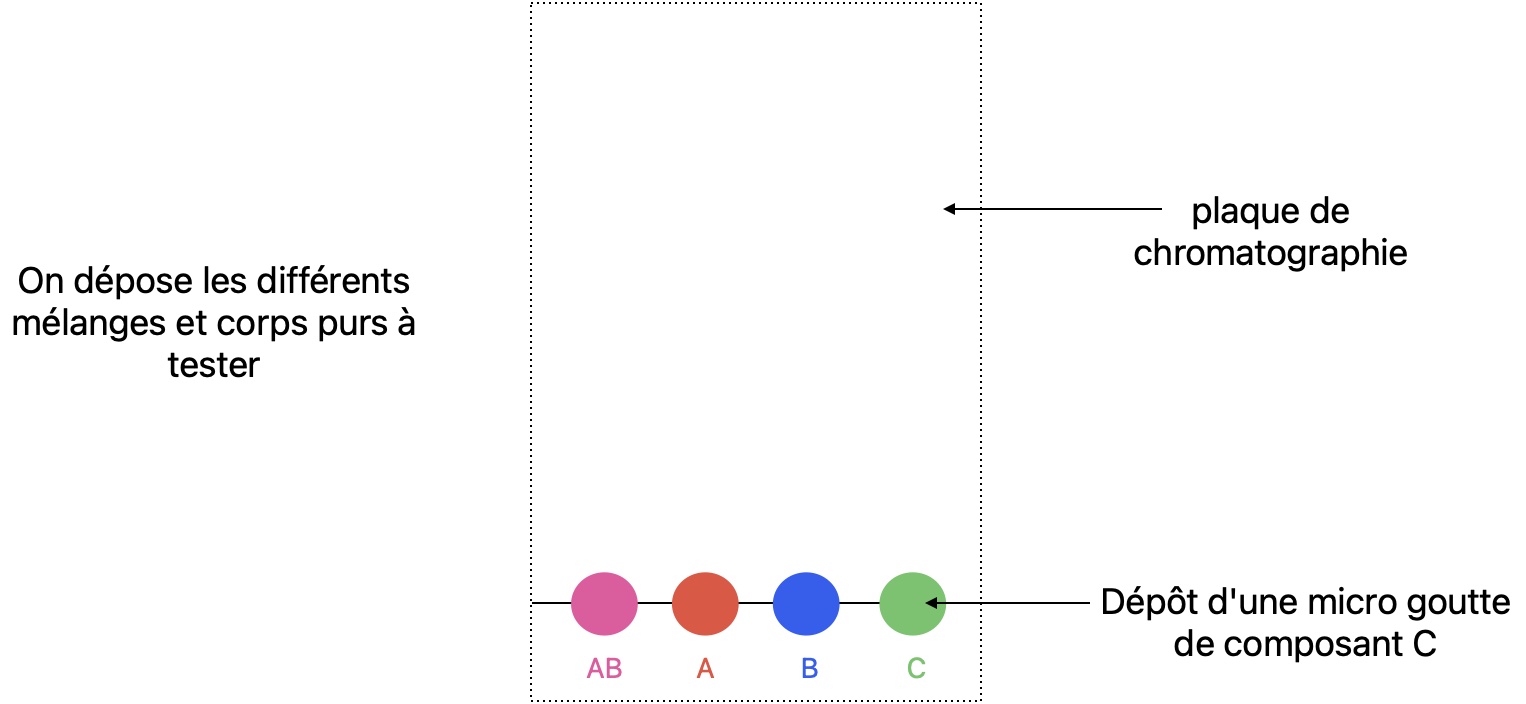
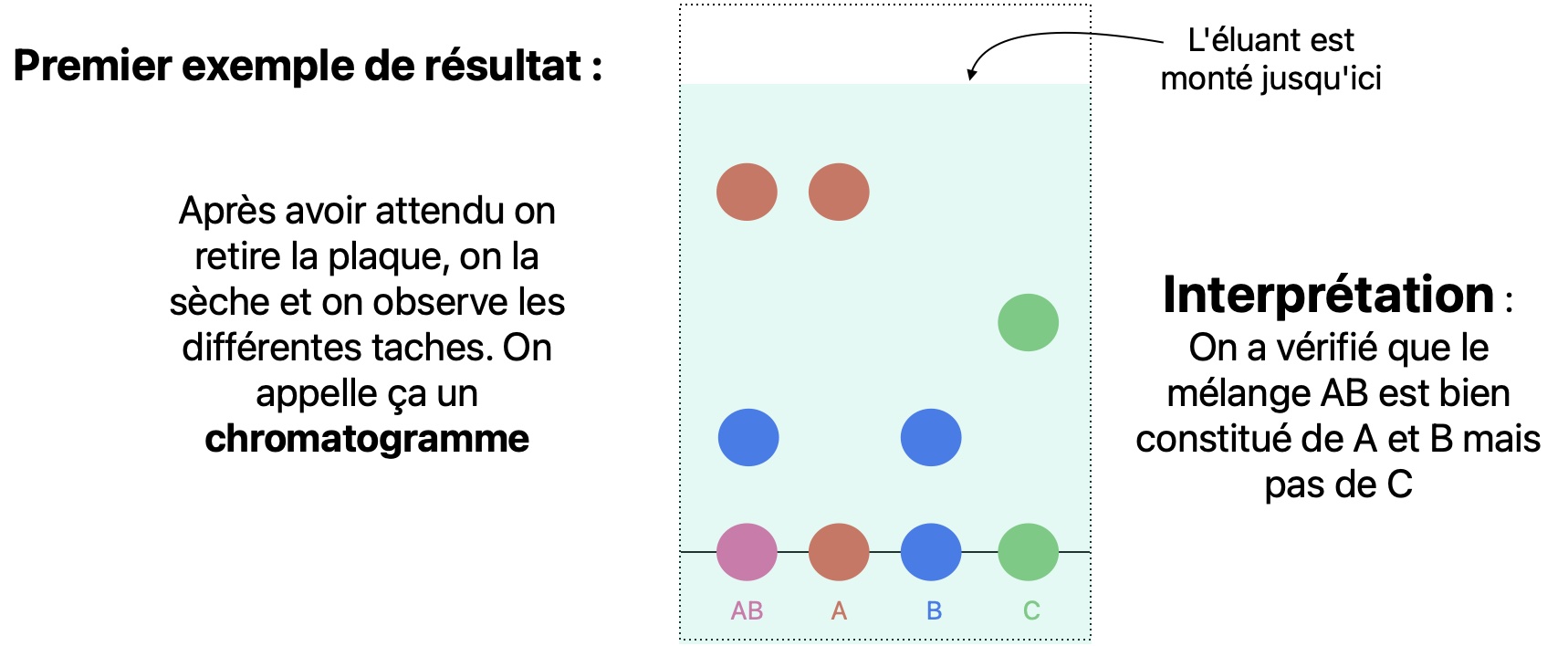
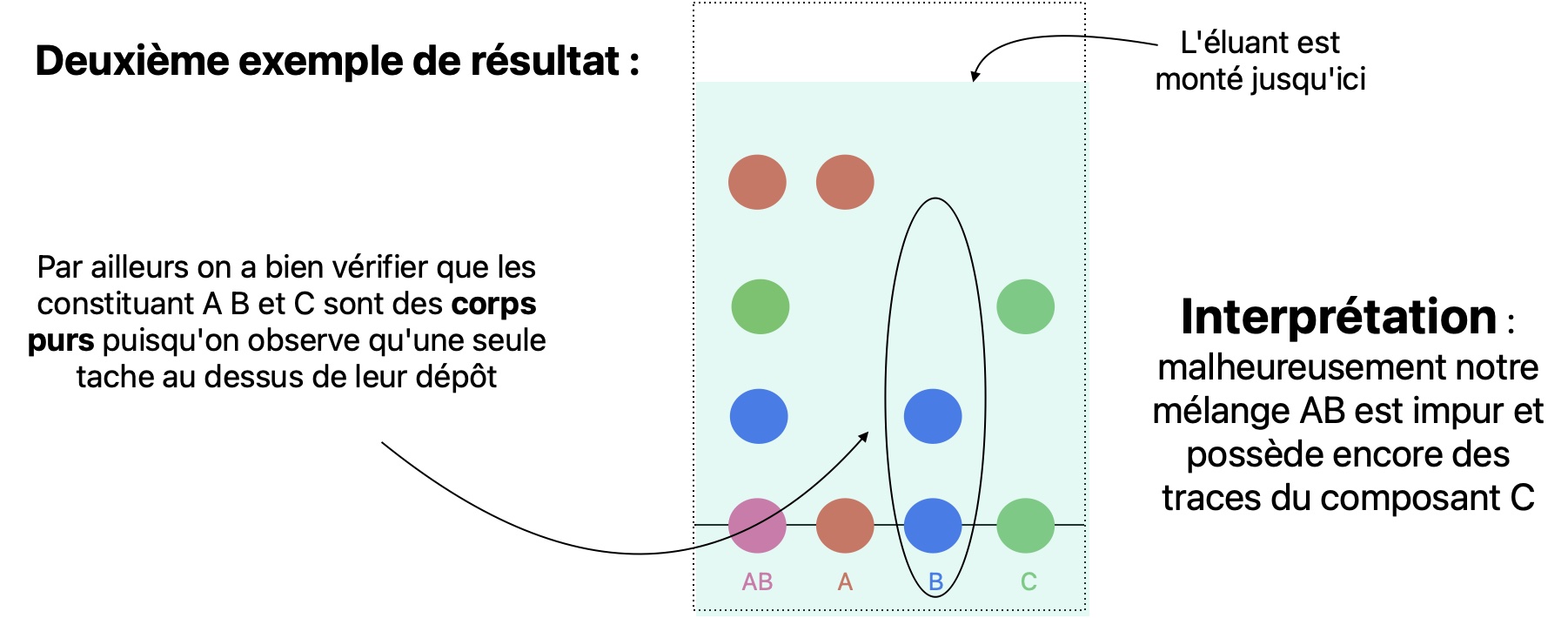
Vous trouverez le détail sur la CCM p305 du livre. Je donne ici un aperçu. Vous pouvez aussi regarder la vidéo suivante La CCM par Gérard Moreau.
On veut verifier que le mélange AB est bien constitué du constituant A et du constituant B et qu'il ne reste pas de constituant C.
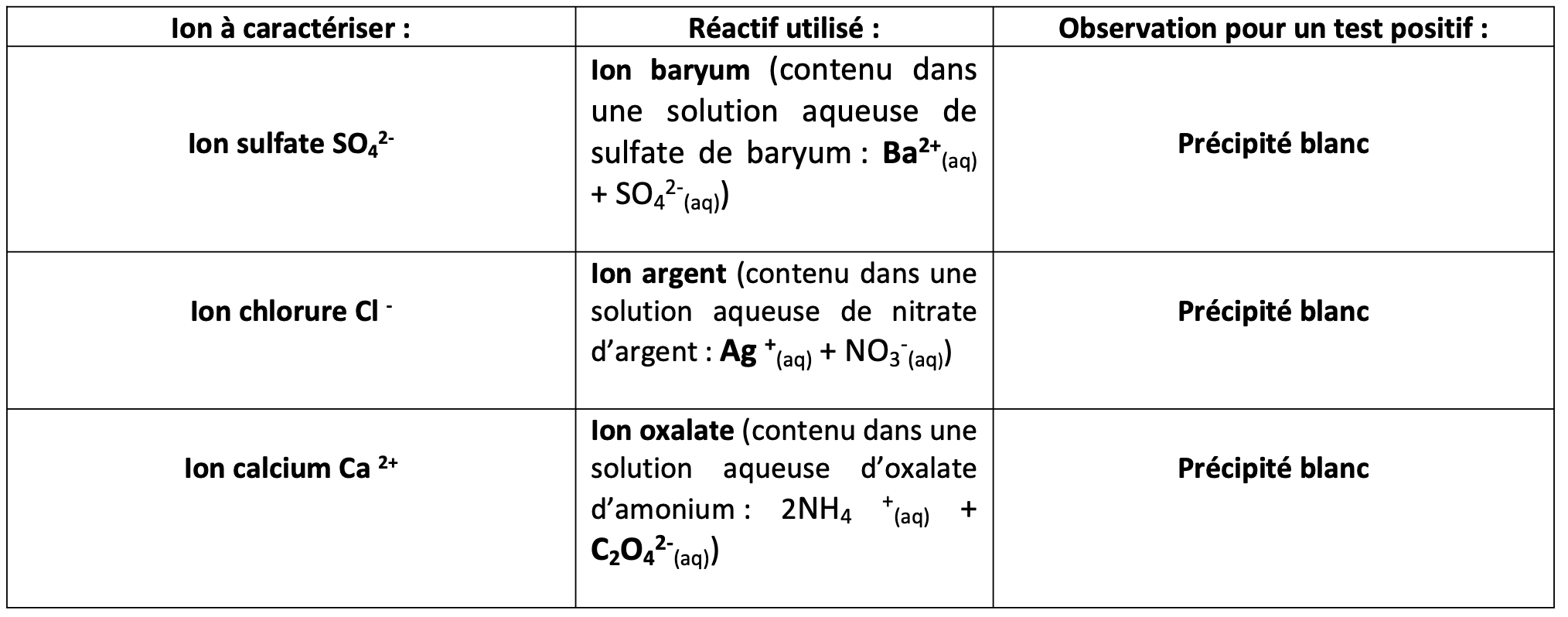
4. Tests chimiques
Pour identifier la présence d'une espèce chimique, on peut utiliser des réactions chimiques qui font intervenir des couleurs ou des sons.
Les tests chimiques à connaître
dans le tube a essai une réaction chimique produit des bulles de gaz, ce gaz c'est du dioxygène. Lorsque la flamme approche l'extrémité du tube la combustion de l'allumette est intensifiée.
A retenir
- Le sulfate de cuivre anhydre permet de révéler l'eau
- le test de la flamme permet de révéler de dihydrogène
- L'oxygène intensifie une réaction de combustion donc on peut révéler sa présence grâce à une allumette
- L'eau de chaux se trouble en présence de dioxyde de carbone
Capacité expérimentale
Vous devrez être en mesure de mettre en oeuvre un protocole pour appliquer des tests chimiques en vous appuyant sur des documents mis a votre disposition. Par exemple, à l'aide du document ci-dessous on doit être capable d'élaborer un protocole pour identifier les espèces chimiques présentes dans de l'eau minérale.
5. Masse Volumique
Définition
Exemples
- Si vous pesez un litre d'eau (\(V =\) 1 Litre) il fera exactement un kilogramme (\(m =\) 1 kg) donc la masse volumique de l'eau est : \(\rho_{eau} = 1 kg.L^{-1}\)
- Si vous pesez un litre d'huile (\(V =\) 1 Litre) il fera exactement 920 grammes (\(m =\) 0,920 kg) donc la masse volumique de l'huile est : \(\rho_{huile} = 0,920 kg.L^{-1}\) c'est pour ça que l'huile flotte sur l'eau
- Si vous pesez un mètre cube d'air (\(V = 1 m^3\)) il fera exactement 1,2 kilogramme (\(m =\) 1,2 kg) donc la masse volumique de l'air est : \(\rho_{air} = 1,2 kg.m^{-3}\)
je vous laisse faire la conversion mais nous retiendrons que la masse volumique de l'air est d'environ \(1 g.L^{-1}\)
à retenir
- La masse volumique de l'eau est : \(\rho_{eau} = 1 kg.L^{-1}\)
- La masse volumique de l'air est d'environ \(1 g.L^{-1}\)
Capacité expérimentale
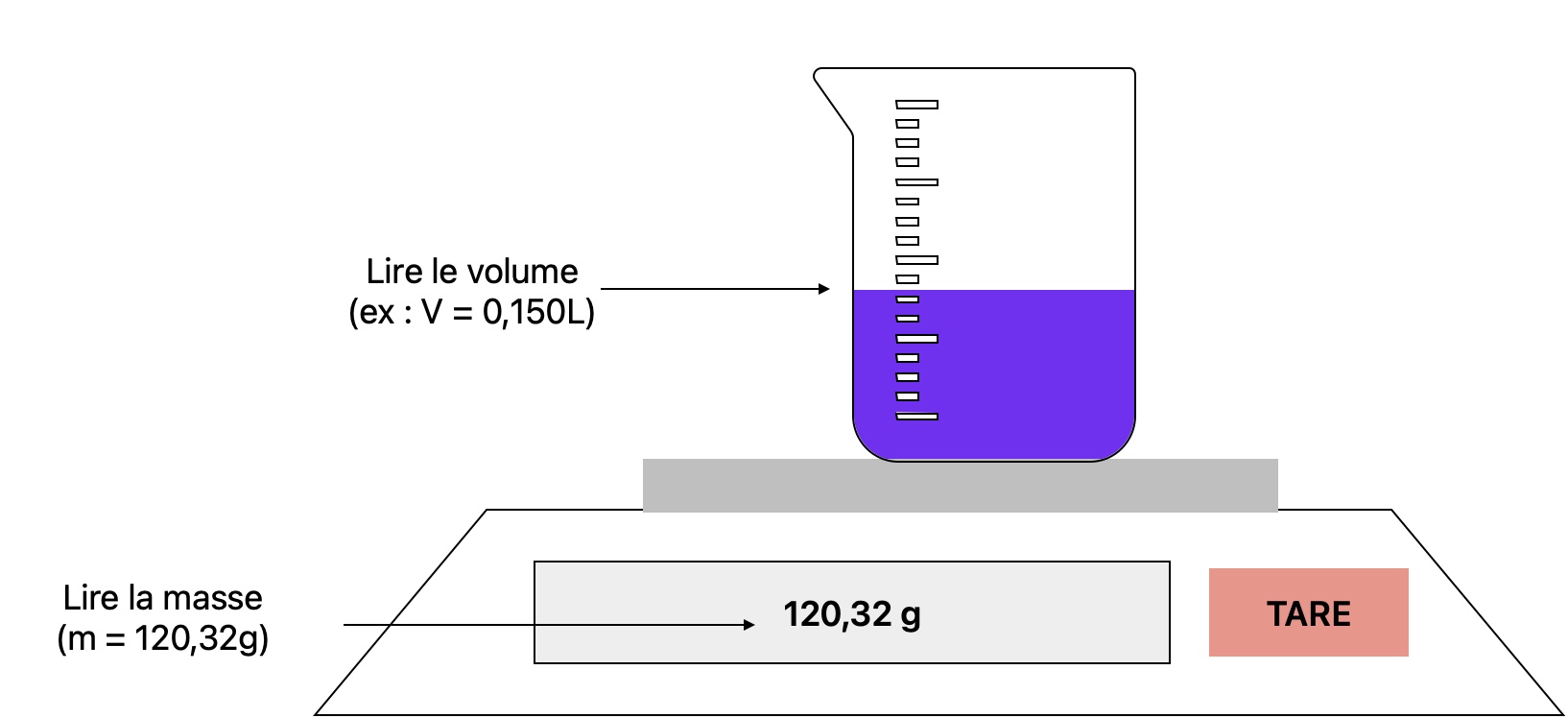
- Posez un récipient gradué sur une balance et appuyer sur TARE
- Versez y le liquide, mesurer le volume à l'aide des graduation et relevez la masse écrite sur la balance
- En déduire la masse volumique en divisant la masse de l'échantillon par son volume
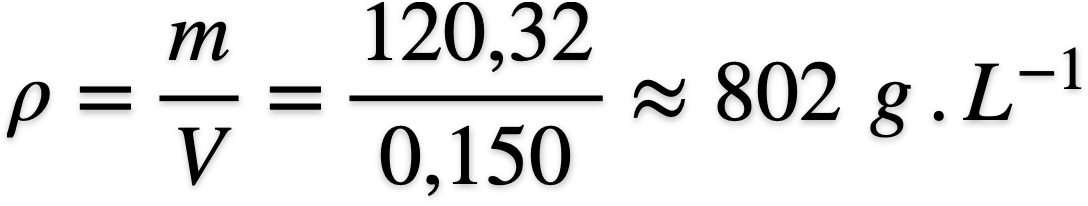
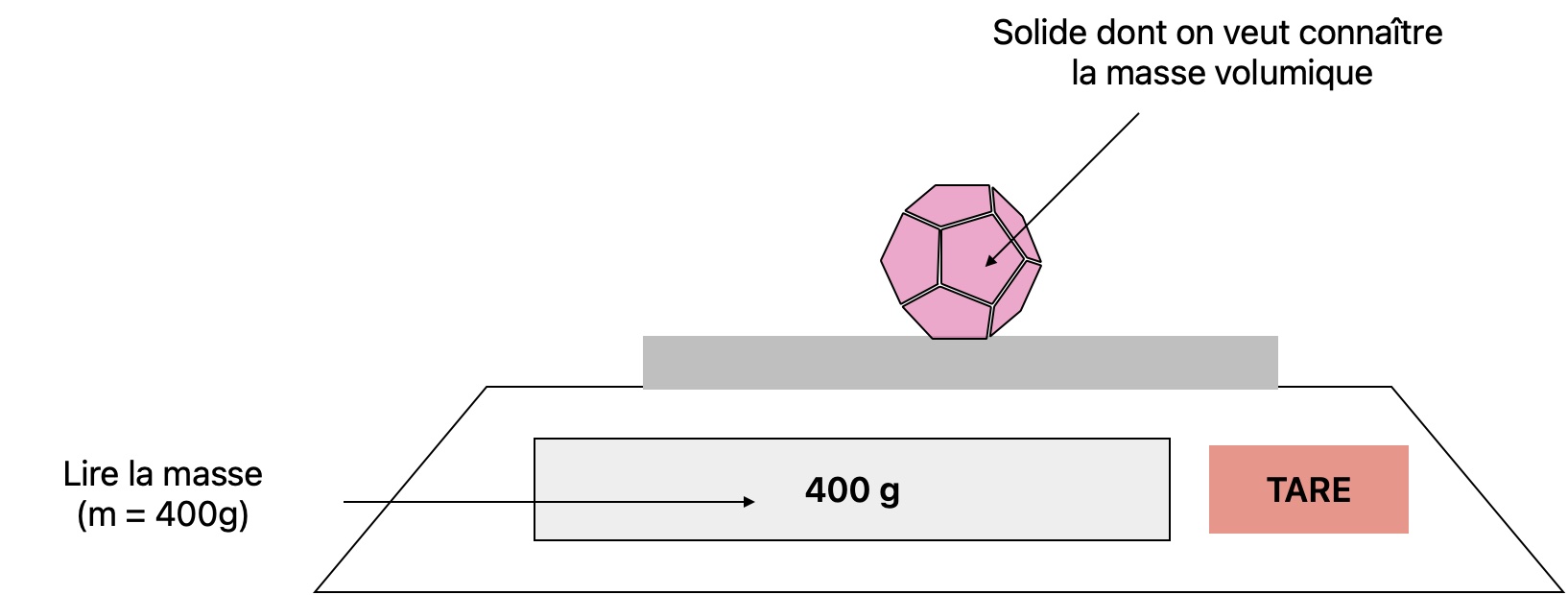
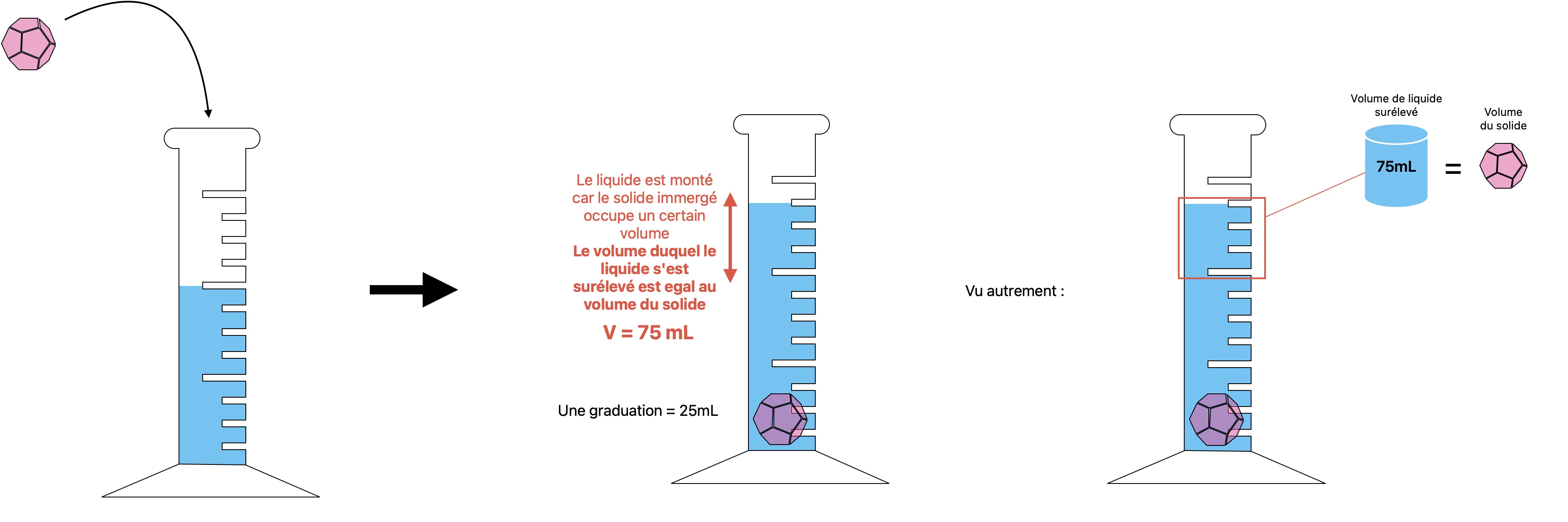
- On obtient la masse en pesant directement le solide sur une balance
- On obtient le volume de l'échantillon solide en observant le volume d'eau déplacé lorsqu'on le plonge dans un récipient
- On peut procéder comme précédemment pour calculer la masse volumique
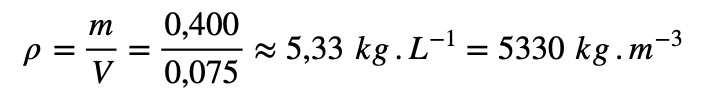
6. Composition
Définitions
La composition massique d'un mélange donne le rapport de la masse de chacun de ses constituants par rapport à la masse totale du mélangeLa composition volumique d'un mélange donne le rapport du volume de chacun de ses constituants par rapport au volume total du mélange
Méthode
Déterminer la composition massique d'un mélange :- déterminer la masse total d'un échantillon
- diviser la masse de chaque constituant par la masse totale
Déterminer la composition volumique d'un mélange :
- déterminer le volume total d'un échantillon
- diviser le volume occupé par chaque constituant dans l'échantillon par le volume total de cet échantillon
Exemples
La composition volumique de l'air :- 78% de diazote (\(N_2\)) en volume
- 21% de dioxygène (\(O_2\)) en volume
- 1% d'autres gaz en volume
Le shortbread est un biscuit écossais dont la recette est très simple :
- 100g de sucre
- 200g de beurre
- 300g de farine
- masse totale : \(m_{totale} = 100+200+300\) \(= 600g\)
- composition massique :
- \(\frac{100}{600} = \frac 1 6 \approx\) 17% de sucre en masse
- \(\frac{200}{600} = \frac 1 3 \approx\) 33% de beurre en masse
- \(\frac{300}{600} = \frac 1 2 \approx\) 50% de farine en masse
Imaginez une pièce fermée de \(150 m^3\) avec à l'intérieur de l'air et un bloc de fer de 8000 kg et d'\(1 \ m^3\)
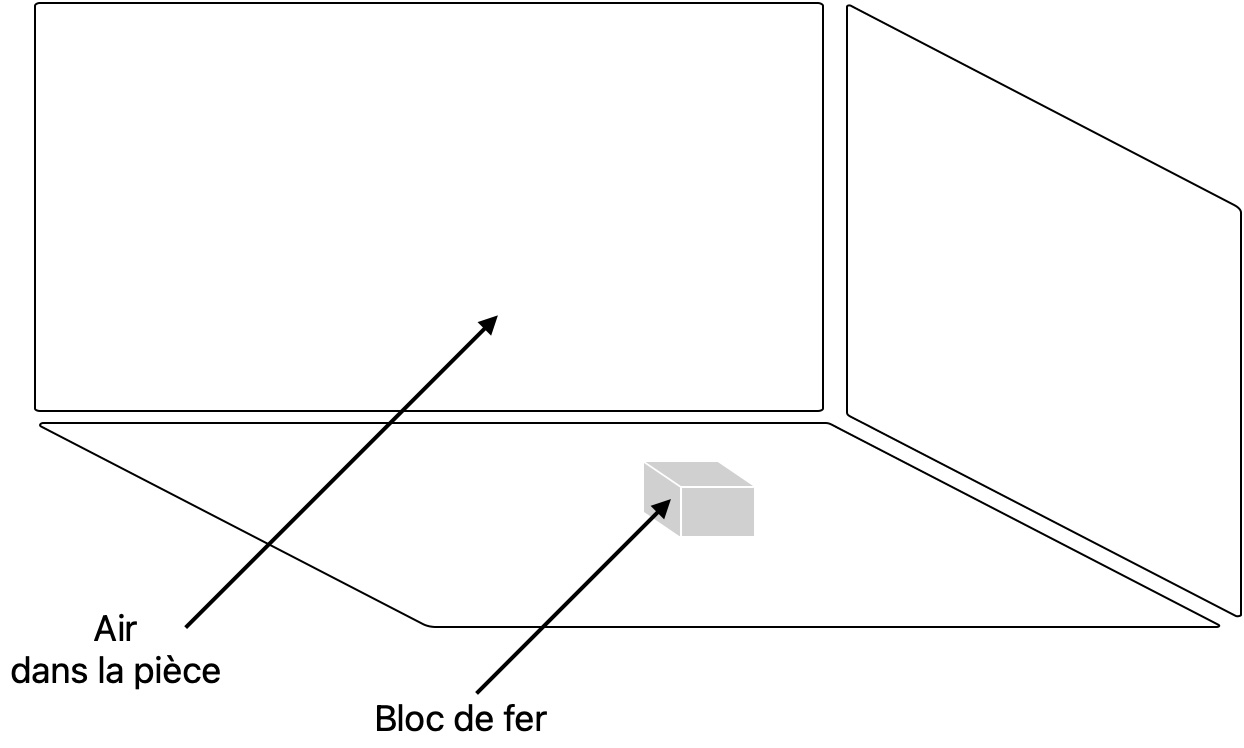
- masse totale : on calcule la masse d'air \(m_{air}\) grâce à sa masse volumique(environ \(1kg.m^{-3})\), en effet on sait qu'il y a environ
\(149 m^3\) d'air donc \(m_{air} \approx 149kg\).
Ainsi \(m_{totale} = m_{bloc de fer} + m_{air}\) \(\approx 8000 + 149 \approx 8149 \ kg \)
- composition massique :
- \(\frac{149}{8149} \approx\) 2% d'air en masse
- \(\frac{8000}{8149} \approx\) 98% de fer en masse
- composition volumique :
- \(\frac{149}{150} \approx\) 99% d'air en volume
- \(\frac{1}{150} \approx\) 1% de fer en volume